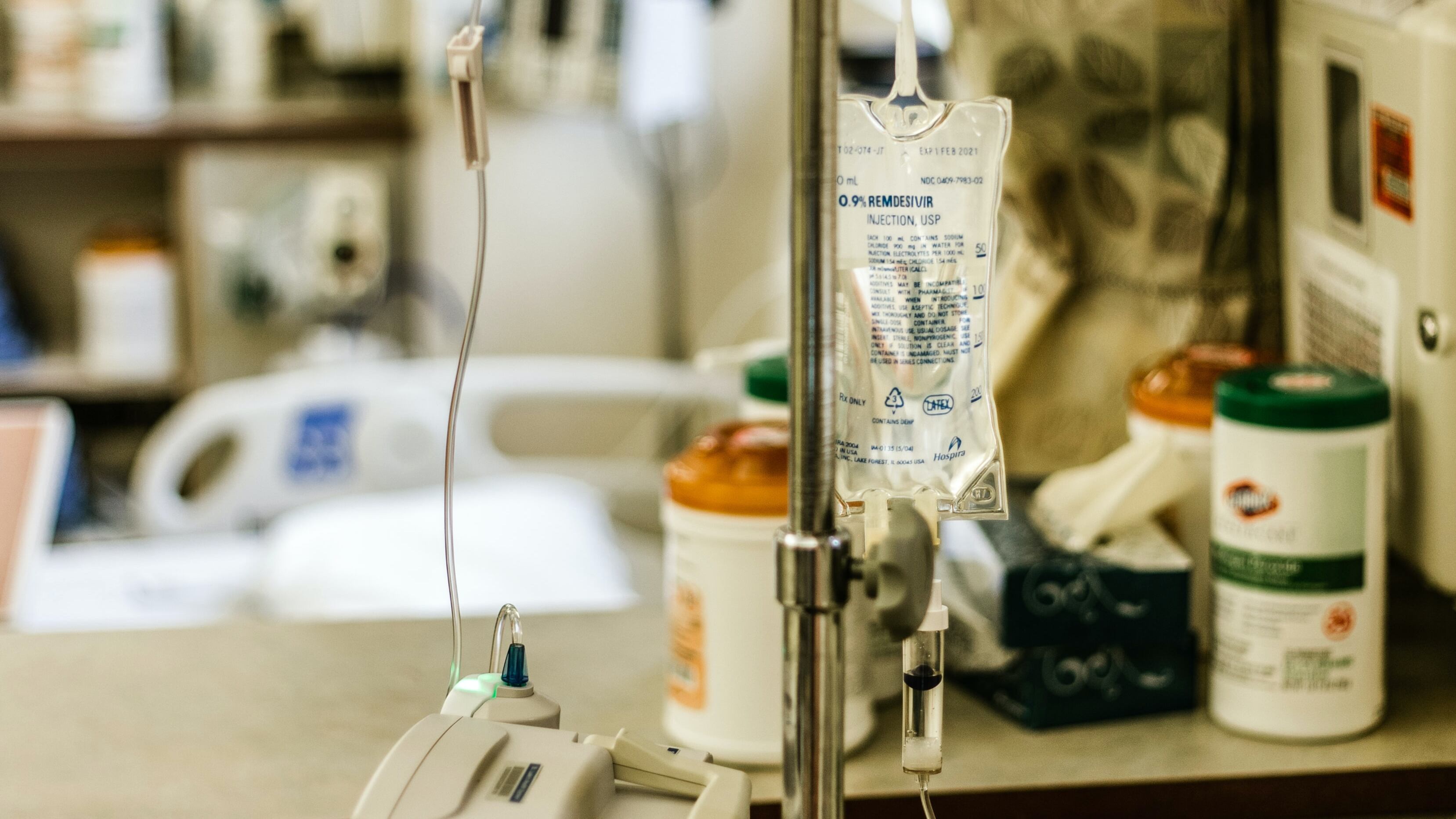
La Administración de Medicamentos y Alimentos de los Estados Unidos (FDA por su siglas en inglés) anunció una expansión en la disponibilidad del tratamiento de COVID-19 con Remdesivir.
PUBLICIDAD
Con este cambio, ciertas personas que han desarrollado el coronavirus de forma leve o moderada, pero que no han sido hospitalizadas, pueden recibir una infusión del medicamento, con el objetivo de que estos pacientes no terminen siendo internados en un centro de asistencia médica.
Remdesivir, que también se llama Veklury, hasta ahora se ha limitado a pacientes con COVID-19 hospitalizados con la enfermedad, según explica el sitio web de Slash Gear en su reporte.
El medicamento antiviral, que se administra mediante una infusión intravenosa, ayuda a evitar que el coronavirus progrese a un estado grave.
[ Ómicron no marcará el fin de la pandemia: creador de la Sputnik VOpens in new window ]
También para Ómicron
Además, la FDA ha ampliado el uso de Remdesivir para incluir a algunas personas que han contraído la Ómicron, pero solo si no han sido hospitalizadas.
La directora del Centro de Evaluación e Investigación de Medicamentos de la FDA, Patrizia Cavazzoni, explicó en un comunicado oficial: “Después de la reciente autorización de la FDA de dos medicamentos antivirales orales, las acciones de hoy refuerzan el arsenal de terapias para tratar el COVID-19. y responder al aumento de la variante Ómicron”.

La expansión del Remdesivir cubre a personas mayores de 12 años que pesan al menos 88 libras, según la FDA, que señala que este cambio está destinado a aquellos que tienen un alto riesgo de desarrollar una infección grave.
Más allá de eso, también se han ampliado las autorizaciones de uso de emergencia (EUA) para usar el medicamento como tratamiento de COVID-19 en niños menores de 12 años, pero solo en caso de aplicarse la EUA.
Esta expansión cubre a los pacientes de alto riesgo que no han sido hospitalizados, suponiendo que pesen entre 7,7 libras y menos de 88 libras. Además, permite tratar a niños menores de 12 años siempre que pesen no menos de 7.7 libras, nuevamente, si se considera que tienen un alto riesgo de hospitalización y muerte.
La FDA señala que las dosis administradas a pacientes pediátricos se ajustarán en función del peso corporal. Además, advierte que el Remdesivir no es un sustituto de la vacuna, que incluyendo la inyección de refuerzo, sigue siendo el mejor método de protección contra el COVID-19.